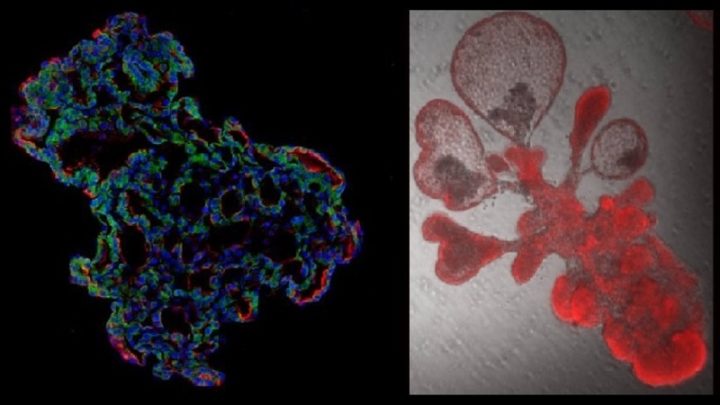
Científicos estadounidenses, británicos y surcoreanos en dos estudios separados han desarrollado en laboratorio modelos de ‘minipulmones’ humanos a partir de las células madre para investigar a la escala molecular más fina dónde exactamente se produce la infección por coronavirus en el tejido pulmonar y posteriormente probar medicamentos potenciales contra el covid-19.
Ambas investigaciones fueron publicadas este 21 de octubre en Cell Stem Cell, una la revista científica especializada en el campo de las células madre.
Primeros ‘minipulmones’ 100% humanos
El nuevo coronavirus daña los alvéolos, provocando neumonía y dificultad respiratoria aguda, la principal causa de muerte en pacientes con covid-19, pero hasta ahora los estudios de la enfermedad se han visto obstaculizados por la falta de modelos experimentales que imiten los tejidos pulmonares humanos.
Un equipo de la Universidad de Duke (EE.UU.), dirigido por el biólogo celular Purushothama Rao Tata, ha desarrollado un modelo que utiliza «organoides pulmonares», también denominados ‘minipulmones de laboratorio’. Los organoides se cultivaron a partir de células epiteliales alveolares tipo 2 (AT2), que son las células madre que reparan las partes más profundas de los pulmones donde ataca el SARS-CoV-2.
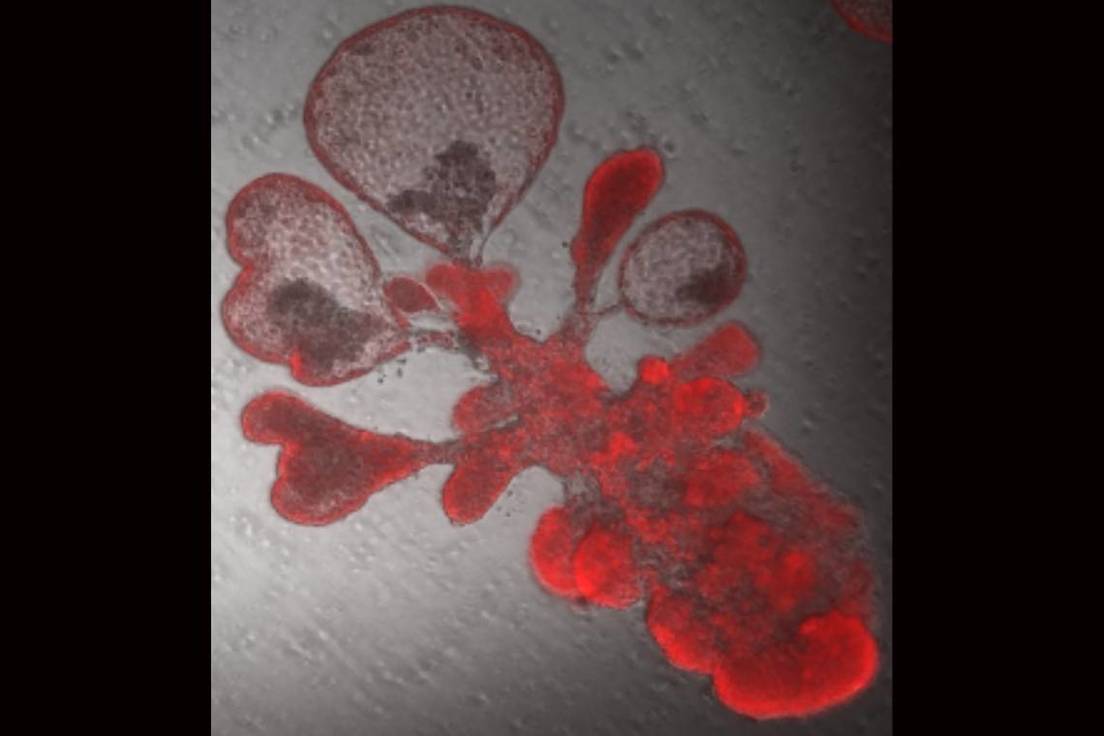
El grupo de Tata logró crear organoides puramente humanos sin células auxiliares. Estos ‘minipulmones’ permitirán realizar cientos de experimentos simultáneos para detectar nuevos candidatos a fármacos o identificar sustancias químicas de autodefensa producidas por las células pulmonares en respuesta a una infección.
«Este es un sistema modelo versátil que nos permite estudiar no solo el SARS-CoV-2, sino también cualquier virus respiratorio que se dirija a estas células, incluida la influenza», dijo Tata.
«Este es un gran avance para este campo porque [antes] usábamos células que no tenían cultivos purificados», añadió Ralph Baric, coautor del artículo, un eminente profesor de epidemiología, microbiología e inmunología en la Universidad de Carolina del Norte, que colaboró en la investigación.
El estudio demostró que el coronavirus se ubica en la superficie del receptor ACE2 de las células pulmonares, lo que provoca la infección. Ante ello, los organoides emiten una respuesta inflamatoria mediada por interferones. Los investigadores también han sido testigos de la tormenta de citocinas de moléculas inmunes que los pulmones lanzan en respuesta al virus.
«Se pensaba que la tormenta de citocinas se debía a la gran afluencia de células inmunitarias, pero podemos ver que también ocurre en las propias células madre pulmonares«, señaló Tata.
El laboratorio de Tata descubrió que las células producían interferones y experimentaron una muerte celular autodestructiva, tal como lo han demostrado las muestras de pacientes con covid-19. La señal del suicidio celular en ocasiones se activaba también en células pulmonares vecinas no infectadas, ya que las células luchaban por adelantarse al virus. Los investigadores también compararon los patrones de actividad genética entre los ‘minipulmones’ y las muestras de seis pacientes graves con covid-19 y observaron que ambos coincidían con una «sorprendente similitud».
«Hasta ahora esto solo habíamos podido verlo en autopsias. Actualmente tenemos una manera de descubrir cómo energizar las células para luchar contra este virus mortal», señaló Tata.
Infección en 6 horas, muerte celular en 60
En otro estudio, científicos de la Universidad de Cambridge (Reino Unido) y varias universidades surcoreanas utilizaron para su investigación tejido donado a bancos de tejidos para extraer células alveolares tipo 2 (AT2) del pulmón humano. Al reprogramar estas células a su etapa anterior de células madre, pudieron desarrollar estructuras 3D de tipo alveolar autoorganizadas que imitan el comportamiento del tejido pulmonar clave.
El equipo, liderado por el doctor Joo-Hyeon Lee, infectó los organoides con una cepa de SARS-CoV-2 tomada de un paciente de Corea del Sur que fue diagnosticado con covid-19 en enero después de viajar a Wuhan, la ciudad china donde se originó la pandemia. Usando una combinación de imágenes de fluorescencia y análisis genético de células individuales, pudieron estudiar cómo respondían las células al virus.
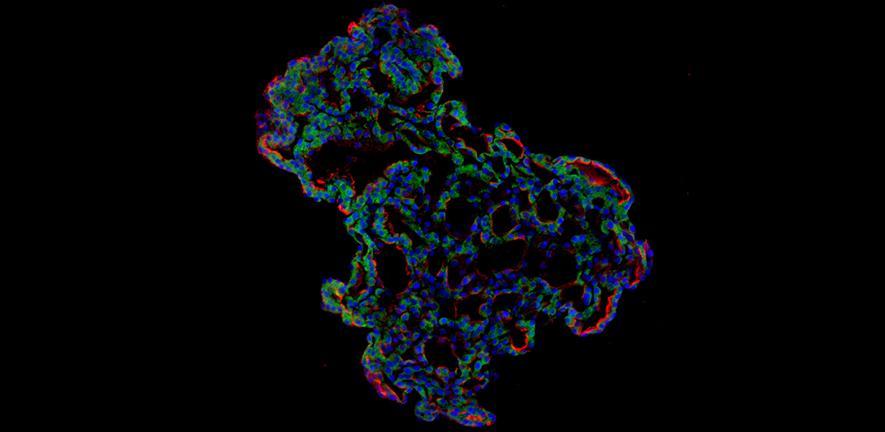
Cuando los modelos 3D se expusieron al SARS-CoV-2, el virus comenzó a replicarse rápidamente, alcanzando la infección celular completa solo seis horas después de la infección. Casi al mismo tiempo, las células comenzaron a producir interferones, proteínas que actúan como señales de advertencia para las células vecinas indicándoles que activen sus defensas antivirales. Después de 48 horas, los interferones desencadenaron la respuesta inmune innata, su primera línea de defensa, y las células comenzaron a luchar contra la infección.
60 horas después de la infección, un subconjunto de células alveolares comenzó a desintegrarse, provocando la muerte celular y daño al tejido pulmonar de manera mucho más rápida que en los pacientes con covid-19. El equipo señala que hay varias posibles razones que explican esta reacción, como por ejemplo, que pueden pasar varios días desde que el virus se infiltra por primera vez en el tracto respiratorio superior hasta que alcanza los alvéolos.
«Basándonos en nuestro modelo, podemos abordar muchas preguntas clave sin respuesta, como comprender la susceptibilidad genética al SARS-CoV-2, evaluar la infectividad relativa de mutantes virales y revelar los procesos de daño del virus en las células alveolares humanas», declaró el doctor Young Seok Ju, coautor principal y profesor asociado en el Instituto Avanzado de Ciencia y Tecnología de Corea. «Lo más importante es que brinda la oportunidad de desarrollar y detectar posibles agentes terapéuticos contra la infección por el SARS-CoV-2″.
«Esperamos utilizar nuestra técnica para hacer crecer estos modelos 3D a partir de células de pacientes que son particularmente vulnerables a las infecciones, como los ancianos o las personas con enfermedades pulmonares, y descubrir qué les sucede a sus tejidos», añadió Lee.